Pourquoi ne fabrique-t-on pas de l'eau en masse si nous connaissons sa formule moléculaire ?
La crise de l'eau nous oblige à travailler sur de nouvelles technologies pour réutiliser la ressource la plus précieuse pour la vie. Mais, peut-être vous demandez-vous pourquoi nous ne la créons pas directement à partir de zéro dans les laboratoires, puisque nous savons que H2O est sa "recette".

Nous connaissons plusieurs méthodes physiques et chimiques pour capter, dessaler, purifier, rendre potable et redistribuer l'eau, afin de pouvoir réutiliser cette ressource vitale. Bien que les technologies aient progressé dans ce domaine avec des méthodes de plus en plus efficaces, cela n'est pas suffisant et la crise de l'eau continue de s'aggraver.
De la combinaison de deux atomes d'hydrogène (H) et d'un atome d'oxygène (O), on obtient : H2O (monoxide de dihydrogène), qui est la formule moléculaire de l'eau. Nous avons les ingrédients disponibles mais, de toute évidence, une des étapes de "cette recette" ne doit pas être simple à réaliser en laboratoire, et il y a des raisons pour ne pas la créer en masse.
Est-il possible de fabriquer de l'eau ?
Oui, le processus de "fabrication" de l'eau à partir de zéro est possible, mais il y a une (ou deux) raisons fondamentales pour lesquelles cela ne se fait pas en masse. C'est pourquoi la science recherche continuellement des alternatives technologiques pour trouver la meilleure méthode de réutilisation de l'eau, car nous ne sommes pas capables de créer des sources inépuisables d'"eau nouvelle artificielle" à grande échelle, et encore moins de les installer à des endroits stratégiques de la planète pour mettre fin à la crise hydrique. Nous vous expliquons pourquoi on ne fabrique pas d'eau à partir de zéro.
Création de l'eau : électrolyse et photolyse
L'eau en laboratoire peut être obtenue par deux processus principaux : l'électrolyse et la photolyse.
L'électrolyse est le processus par lequel l'eau est divisée en ses composants de base, oxygène et hydrogène, par l'application d'un courant électrique. L'oxygène est libéré à une électrode et l'hydrogène à l'autre. Ces deux gaz peuvent alors être collectés et recombinés pour créer à nouveau de l'eau. Ce processus est utilisé dans certaines applications industrielles, comme la production d'hydrogène comme carburant.

D'autre part, la photolyse implique la séparation de l'eau en ses composants de base par exposition à la lumière. Cela est réalisé en utilisant un photocatalyseur, qui est un matériau qui absorbe la lumière et catalyse la réaction chimique. L'oxygène et l'hydrogène peuvent ensuite être collectés de la même manière que dans l'électrolyse.
Dans les deux méthodes de création, une énorme quantité d'énergie est requise, rendant ce processus inefficace et extrêmement dangereux. Cependant, ces processus sont essentiels dans certaines applications industrielles et peuvent avoir des implications importantes dans la recherche sur les technologies vertes et la production de carburants propres.
Progrès dans la production d'eau
Les scientifiques ont travaillé pendant des années à trouver différentes manières de créer de l'eau. Un groupe éminent du Département de Chimie de l'Université de l'Illinois, aux États-Unis, a publié en 2007 une nouvelle façon de produire de l'eau évitant une grande explosion. Néanmoins, ce processus reste très coûteux et n'est pas efficace non plus, mais peut être utilisé à d'autres fins importantes.
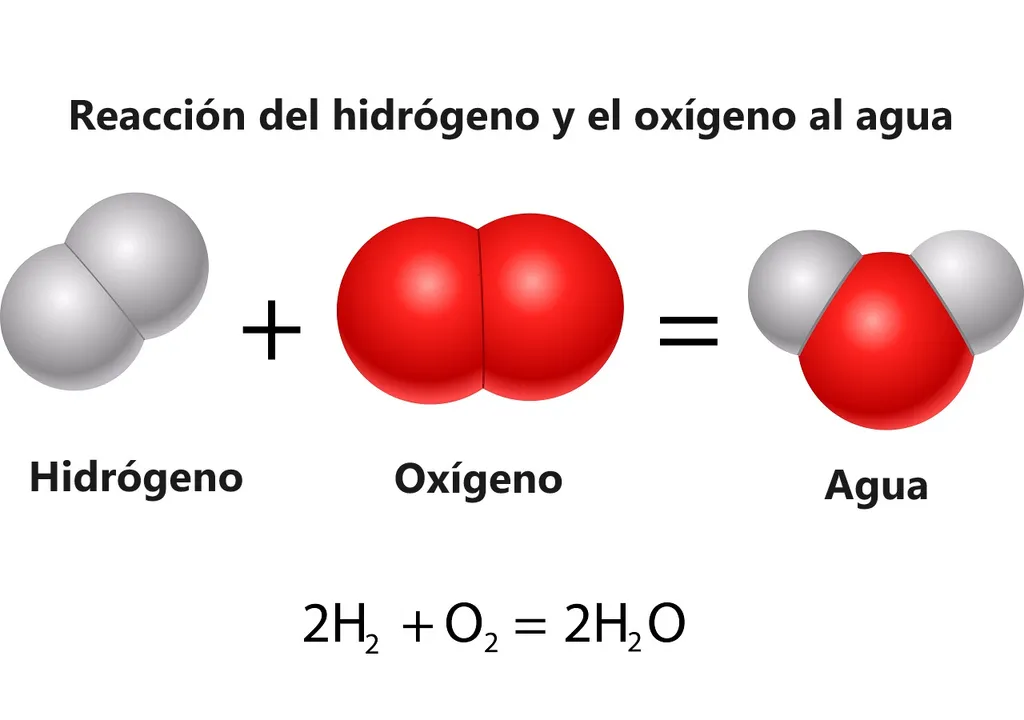
“La réaction (2H2 + O2 = 2H2O + Énergie) est connue depuis des siècles, mais jusqu'à présent, personne ne l'avait réalisée dans une solution homogène”, a déclaré Thomas Rauchfuss, professeur de chimie de cette université et auteur principal de l'article.
La réaction connue décrit également ce qui se passe à l'intérieur d'une pile à combustible à hydrogène. Dans une cellule à combustible typique, le gaz dihydrogène (H2) entre d'un côté de la cellule et le gaz dioxygène (O2) de l'autre côté.

Les molécules d'hydrogène perdent leurs électrons et deviennent positivement chargées par un processus appelé oxydation, tandis que les molécules d'oxygène gagnent quatre électrons et deviennent négativement chargées par un processus appelé réduction. Les ions oxygène négativement chargés se combinent avec les ions hydrogène positivement chargés pour former de l'eau et libérer de l'énergie électrique.
"Le côté difficile" de la pile à combustible est la réaction de réduction de l'oxygène, et non la réaction d'oxydation de l'hydrogène, a déclaré Rauchfuss. "Cependant, nous avons découvert que de nouveaux catalyseurs pour la réduction de l'oxygène pourraient également conduire à de nouveaux moyens chimiques pour l'oxydation de l'hydrogène".
Rauchfuss et Heiden étudient récemment une génération relativement nouvelle de catalyseurs d'hydrogénation par transfert pour leur utilisation en tant qu'hydrures métalliques non conventionnels pour la réduction de l'oxygène.
Ces chercheurs se concentrent sur la réactivité oxydative des catalyseurs d'hydrogénation par transfert à base d'iridium dans une solution homogène non aqueuse. Ils ont découvert que le complexe d'iridium affecte à la fois l'oxydation des alcools et la réduction de l'oxygène.
"La plupart des composés réagissent avec l'hydrogène ou l'oxygène, mais ce catalyseur réagit avec les deux", a déclaré Heiden. "Il réagit avec l'hydrogène pour former un hydrure, puis réagit avec l'oxygène pour former de l'eau ; et il le fait dans une cartouche homogène et non aqueuse". Les nouveaux catalyseurs pourraient conduire au développement final de piles à combustible à hydrogène plus efficaces, réduisant substantiellement leur coût, a déclaré Heiden.
La solution est : ne pas polluer l'eau
L'essentiel du problème de la crise de l'eau est de comprendre que l'eau ne s'épuise pas, la quantité d'eau que nous avons sur Terre a toujours été la même. Ce qui se passe, c'est que nous la polluons, et dans certaines régions, elle n'est plus facilement disponible. Cela est l'une des conséquences de la dégradation des écosystèmes (forêts et zones humides, par exemple), qui font partie du cycle de l'eau, filtrent et stockent également cette ressource vitale, la laissant propre et en quantités suffisantes.

Par conséquent, nous devons arrêter la pollution de l'eau, nous devons augmenter la quantité de végétation et protéger les écosystèmes existants.
De plus, il est très nécessaire d'apprendre la gestion et l'utilisation consciente de l'eau. Pour le mettre en chiffres, produire 1 kilogramme de viande de boeuf peut consommer entre 500 et 20 000 litres d'eau selon le pays et le lieu d'origine de la viande. Selon les données de l'ONU, l'industrie textile est responsable de 20% de l'eau contaminée dans le monde ; par exemple, pour fabriquer un jean, entre 2 000 et 3 000 litres d'eau sont nécessaires, selon une étude réalisée à l'Université Polytechnique de Madrid.